Lebensmittel und Getränke: Zell Desintegration
ANWENDUNGSZWECK
Aufbrechen von Hefezellen, um die Extraktion wertvoller Verbindungen zu ermöglichen, die für die Lebensmittel- und Getränkeindustrie von Interesse sind, wie Enzyme, Pigmente, Vitamine oder bioaktive Verbindungen.
HERAUSFORDERUNGEN
Das Aufbrechen der Zellwand ist für eine effiziente Extraktion der intrazellulären Bestandteile entscheidend1. Das Aufbrechen kann sich als recht schwierig erweisen, da die Hefezellen durch eine starre Zellwand geschützt sind, die gegen eine Lyse schützt.
WIE HABEN WIR ES GESCHAFFT?
Hefe ist eine attraktive und wirtschaftliche Quelle für Proteine, Enzyme, Polysaccharide und sogar Öle. Beispielsweise wird S. cerevisiae in großem Umfang für die Proteinproduktion verwendet, einschließlich Single Cell Protein (SCP) für Tierfutter und menschliche Ernährung. Sie wird auch in Nahrungsergänzungsmitteln und natürlichen Aromastoffen für die Lebensmittelindustrie verwendet2. Eine andere Hefe, Y. lipolytica, ist für ihre Fähigkeit bekannt, Lipase abzusondern, die in der Lebensmittel-, Pharma- und Umweltindustrie wertvoll ist. Außerdem kann sie unter nährstoffbeschränkenden Bedingungen Zitronensäure produzieren und Einzelzellöl (SCO) anreichern, das als Ersatz für Kakaobutter verwendet werden kann3.
Es wurden verschiedene mechanische Methoden zur Zelllyse erforscht, z. B. Hochdruckhomogenisierung, Kugelmühle und Rotor-Stator-Systeme. Kinematica ist bekannt für seine Rotor-Stator-Anlagen, die nachweislich bestimmte Zellen aufbrechen, wie z. B. den Pilz Fusarium, für den die DNA-Isolierung mit Hilfe des POLYTRON® PT 1200C durchgeführt wurde4. Die Hochdruckhomogenisierung ist jedoch für ein breiteres Spektrum von Zelltypen geeignet und kann eine hohe Dispergiereffizienz erzielen.
Kinematica engagiert sich für Spitzentechnologien mit höchster Effizienz, die über Rotor-Stator-Systeme hinausgehen. So entstand in Zusammenarbeit mit der ETH Zürich die neuartige ATOMIX® als Alternative zu herkömmlichen Hochdruckhomogenisatoren. Mit seinem neuen und patentierten Design der Arbeitskammer löst ATOMIX® die Probleme, die herkömmliche Geräte aufweisen.
DIE KINEMATICA LÖSUNG
Die gebräuchlichsten Arbeitskammern (auch Interaktionskammern genannt) werden in zwei Gruppen unterteilt: den Radialdiffusor und den Gegenstrahl-Dispergator5. Diese Konstruktionen der Interaktionskammern ermöglichen zwei Szenarien: entweder trifft ein Flüssigkeitsstrahl auf eine stationäre Wand oder mehrere Strahlen stoßen miteinander zusammen. Diese Konstruktionen fördern Strömungsinteraktionen, die zu Koaleasenz führen können, weisen einige Totzonen auf und es gibt Zonen in der Kammer mit höherer Kavitation.
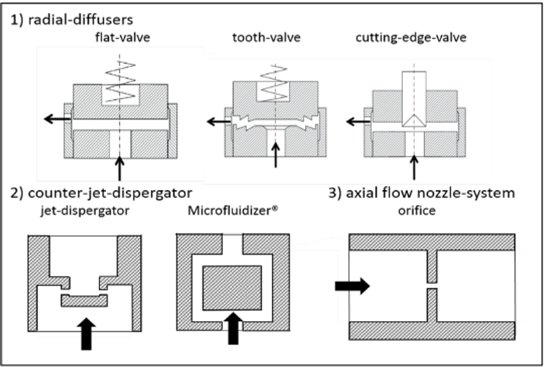
Common interaction chambers in high pressure homogenizers. (Gall et al., 2016)
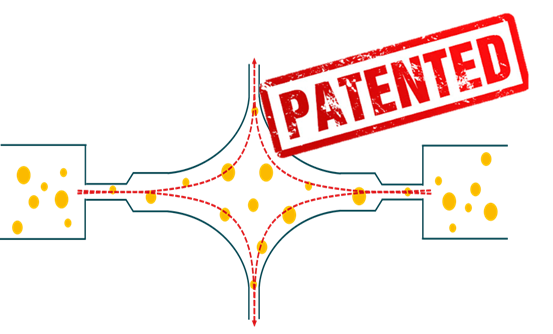
Das spezielle und überarbeitete Design der Arbeitskammer von ATOMIX® enthält eine große Menge an Dehnströmung, die für einen effizienten Tröpfchenaufbruch bei Emulsionen mit hohen Viskositätsverhältnissen entscheidend und für den Zellaufschluss von Vorteil ist. Außerdem weist die Interaktionskammer keine toten Zonen auf, die Kavitation wird reduziert, was die Leistung verbessert, und die Strömung wird kontrolliert, was zu einer besseren Produktqualität führt.
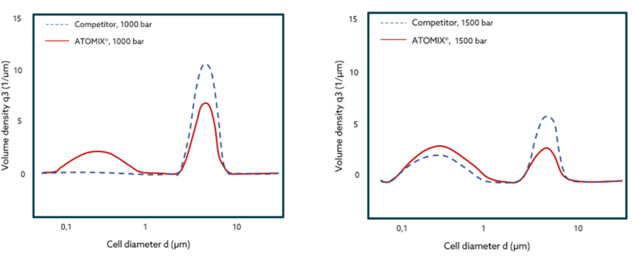
Die Hefezellensuspension wurde mit ATOMIX® und einem beliebten Konkurrenzprodukt verarbeitet. Die Ergebnisse mit ATOMIX® zeigen eine höhere Volumendichte bei kleineren Zelldurchmessern bei gleichem Druck - nach einem Durchgang. Dies führt dazu, dass mehr Zellen in kleinere Partikel aufgespalten werden und somit die Extraktionsprozesse einfacher und mit höherer Ausbeute in kürzerer Zeit ablaufen!
Möchten Sie mehr erfahren? Bitte kontaktieren Sie uns per E-Mail unter science@kinematica.ch
1 Liu, Dan, et al. “Yeast Cell Disruption Strategies for Recovery of Intracellular Bio-Active Compounds — A Review.” Innovative Food Science & Emerging Technologies, vol. 36, 2016, pp. 181–92, https://doi.org/10.1016/j.ifset.2016.06.017.
2 Ganeva, Valentina, et al. “Extraction of Proteins and Other Intracellular Bioactive Compounds From Baker’s Yeasts by Pulsed Electric Field Treatment.” Frontiers in Bioengineering and Biotechnology, vol. 8, Dec. 2020, p. 552335, https://doi.org/10.3389/fbioe.2020.552335.
3 López-Gómez, José Pablo, and Cristina Pérez-Rivero. “Cellular Systems.” Comprehensive Biotechnology, Elsevier, 2019, pp. 9–21, https://doi.org/10.1016/B978-0-444-64046-8.00067-7.
4 de Nijs, Monique, et al. “Isolation of Fusarium DNA for Molecular Analysis with and without Mechanical Cell Disruption.” Journal of Microbiological Methods, vol. 27, no. 1, Sept. 1996, pp. 13–17, https://doi.org/10.1016/0167-7012(96)00920-7.
5 Gall, Vanessa, et al. “Extending Applications of High-Pressure Homogenization by Using Simultaneous Emulsification and Mixing (SEM)—An Overview.” Processes, vol. 4, no. 4, Nov. 2016, p. 46, https://doi.org/10.3390/pr4040046