Pharmazeutisch: Nassvermahlung
ANWENDUNGSZWECK
Deagglomeration von in der pharmazeutischen Industrie häufig verwendeten Wirkstoffen wie Triamcinolonacetonid (TAS) und Betamethasonacetat (BSS) unter Verwendung von Rotor-Stator-Homogenisatoren.
HERAUSFORDERUNGEN
Die Partikelgröße von suspendierten Wirkstoffen wie Triamcinolonacetonid (TAS) und Betamethasonacetat (BSS) kann je nach Formulierung variieren und hat eine breite Ausgangsverteilung. Dies macht den Prozess der Partikelgrößenreduzierung zu einer großen Herausforderung. Die Stabilität der Suspension, die Kontrolle der Prozesstemperatur und die kontinuierliche Kontrolle der Partikelgröße sind entscheidende Parameter für diese Art von Formulierungen.
WIE HABEN WIR DAS ERREICHT?
In der pharmazeutischen Industrie ist das Nassmahlen von Wirkstoffen aufgrund der Vorteile, die es für die Formulierungen bringt, eine gängige Praxis. Durch die Nassvermahlung wird die Oberfläche der Feststoffe vergrößert, wodurch sich die Auflösungsgeschwindigkeit und die Bioverfügbarkeit erhöhen. Dies sind durchaus erwünschte Parameter bei der Formulierung von Arzneimitteln, die zum Beispiel injiziert werden sollen. Die Nassvermahlung ist ein wirksames Verfahren zur Behebung der schlechten Löslichkeit eines neuen Arzneimittels, sie ist im Vergleich zu anderen Methoden kostengünstig und gewährleistet eine enge Größenverteilung der Partikelgröße auf sehr effektive Weise. Andererseits hat sich der Einsatz des Nassmahlens in der pharmazeutischen Industrie unter anderem als Mittel zur Kontrolle der Keimbildung bei bestimmten Wirkstoffen erwiesen, die eine große Breite der metastabilen Zone (MSZW) aufweisen und somit eine langsame Keimbildungs-Kinetik haben. Es hat sich auch gezeigt, dass der Prozessstart und die Zeit bis zum Erreichen des Fließgleichgewichts reduziert werden können 1.
Bei bestimmten Wirkstoffen wie Triamcinolonacetonid und Betamethasonacetat ist es schwierig, die Partikelgröße zu reduzieren, insbesondere wenn die anfänglichen Agglomerate groß sind und die Primärpartikel aufgrund ihrer kompakten Dichte eine breite Größenverteilung aufweisen. In diesen Fällen reicht ein herkömmliches Rotor-Stator-System möglicherweise nicht aus, um die Partikel zu desagglomerieren und ihre Größe wirksam zu verringern. Höhere Schergeschwindigkeiten sind vorteilhaft, um die Einhaltung der Vorschriften bei Anwendungen mit diesen Arten von Wirkstoffen zu gewährleisten.

DIE KINEMATICA-LÖSUNG
MEGATRON® MT-SHS ist eine hervorragende Lösung für die Reduzierung schwieriger API-Größen. Wie bei herkömmlichen Rotor-Stator-Systemen entsteht ein Kanal, wenn der Rotor auf den Stator ausgerichtet ist. Wenn der Schlamm hindurchfließt, prallen die Zähne des Rotors auf die Partikel und liefern die für die Zerkleinerung benötigte Energie.2 Bei Suspensionen ist die Partikelzerkleinerung eine Kombination aus Scher- und Pralleffekten.
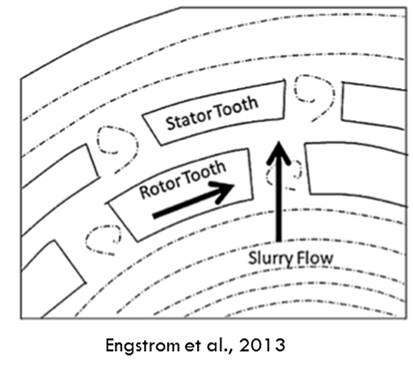

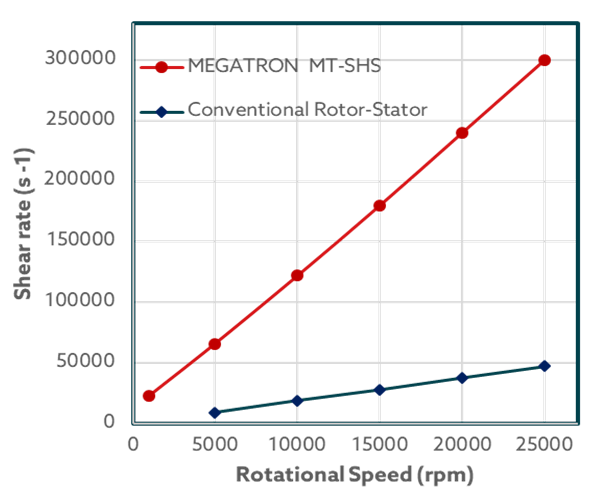
Was unterscheidet den MEGATRON® MT-SHS von herkömmlichen Rotor-Stator-Systemen?
Es geht vor allem um die Optimierung des Scherspaltes. Während bei herkömmlichen Anlagen der Spalt zwischen Rotor und Stator 0,4 - 0,5 mm beträgt, ist er beim MEGATRON® MT-SHS auf nur 0,2 mm reduziert. Diese Verkleinerung wirkt sich direkt auf die Scherraten aus, zumal dieses Gerät eine maximale Drehzahl von 25.000 U/min erreichen kann. Die Scherraten sind bis zu 6-mal höher als bei herkömmlichen Geräten. Diese höhere Effizienz garantiert die gewünschte Partikelgröße
.
Bei der Entwicklung und Herstellung von Arzneimitteln stehen die Wirksamkeit, Sicherheit und Qualität des Produkts im Vordergrund. Die Produktionsstätten stellen strengste Vorschriften und Qualitätsanforderungen, und die geforderten Qualitätsmerkmale werden ständig durch Inprozesskontrollen3 überprüft. Die hervorragende Partnerschaft zwischen KINEMATICA und SOPAT ermöglicht nicht nur die Partikelzerkleinerung, sondern auch die Inline-Messung zur schnellen Qualitätskontrolle. Dies ist ein großer Schritt in der Prozessoptimierung!
Durch die kontinuierliche Messung der Partikelgröße wird die Qualität des Produkts während des gesamten Prozesses sichergestellt, was zu weniger Produktverlusten führt und die Bearbeitungszeit sowie unnötige Produktionsschritte für die entsprechenden Qualitätsmessungen im Offline-Betrieb reduziert. Diese Aspekte sind von entscheidender Bedeutung, wenn man die Auswirkungen der Produktivitätsstopps bedenkt.
Triamcinolonacetonid und Betamethasonacetat wurden mit dem MEGATRON® MT-SHS verarbeitet und die Partikelgröße während des Prozesses wurde mit der SOPAT Ma-Sonde zusammen mit dem U-Light-Aufsatz bewertet. Das U-Licht dient als alternativer Beleuchtungsmodus für die Partikel, was besonders bei dichten Emulsionen, Suspensionen und Aufschlämmungen nützlich ist und es zum perfekten Aufsatz für die Messung der Partikelgröße von Triamcinolonacetonid und Betamethasonacetat macht. Die SOPAT-Sonde wurde zur Messung von Suspensionsproben vor und nach der Homogenisierung verwendet. Der Spalt des U-Lichts wurde auf etwa 1 mm eingestellt, und ein Magnetrührer sorgte für kontinuierliches Rühren bei niedriger Drehzahl (ca. 150-200 U/min). Die Einstellungen für die Sondensteuerung wie Fokusposition und Blitzintensität wurden so lange geändert und eingestellt, bis klare Live-Bilder mit deutlichen Partikelgrenzen zu sehen waren. Die Live-Bild-Analyse wurde mit einem Standard-Bibliotheksworkflow für Suspensionen gestartet.
Als bildbasiertes Inline-Partikelanalysesystem misst SOPAT den Feret-Durchmesser der Partikel. Der maximale Feret-Durchmesser wurde für diese Analyse berücksichtigt. Die Partikelgrößenverringerung für die Triamcinolon-Acetonid- und Betamethason-Suspensionen wird wie folgt als zahlenbasierte Perzentile dargestellt.
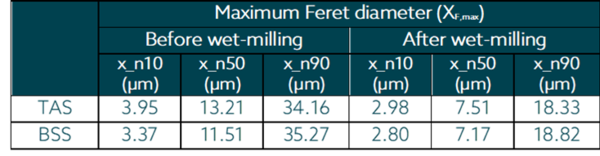

Für Triamcinolonacetonid wurde nach den SOPAT-Ergebnissen eine Partikelgröße Df,max* von 18,33 µm (Ausgangspartikelgröße 34,16 µm) erreicht. Für Betamethasonacetat hingegen wurde eine Partikelgröße von Df,max * von 18,8 µm (Ausgangspartikelgröße 35,27 µm) erreicht. Es ist wichtig zu erwähnen, dass die Ergebnisse der photo-optischen Inline-Messungen mit SOPAT sehr gut mit der Laserbeugungsmethode (die in der pharmazeutischen Industrie weit verbreitet ist) korreliert werden können. Allerdings haben die Ergebnisse möglicherweise nicht den gleichen numerischen Wert. Die Korrelation kann auf der Grundlage der anfänglichen Partikelgröße durchgeführt werden.
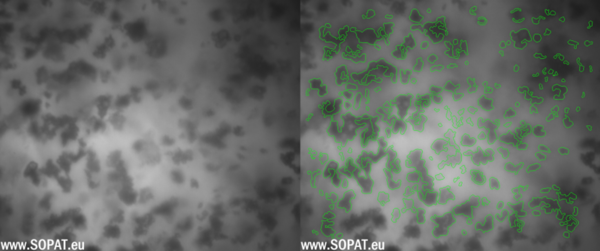
Erste Bilder TAS
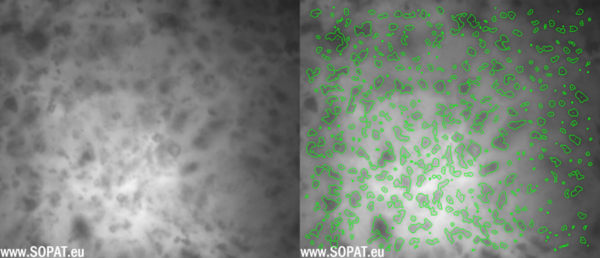
TAS nach Nassmahlung

* 90% zahlenbasierter Wert
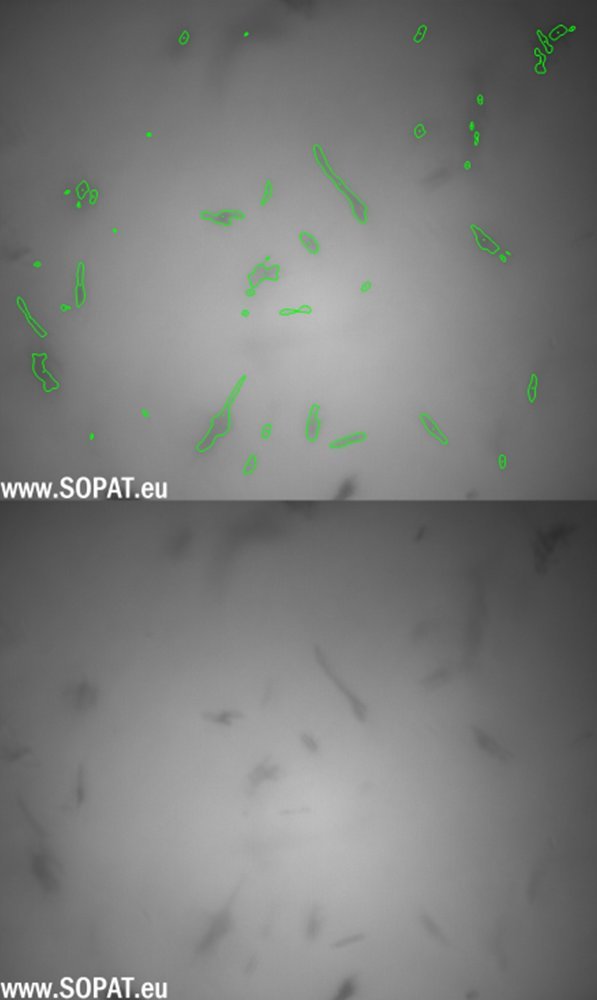

Ausgangsbilder BSS
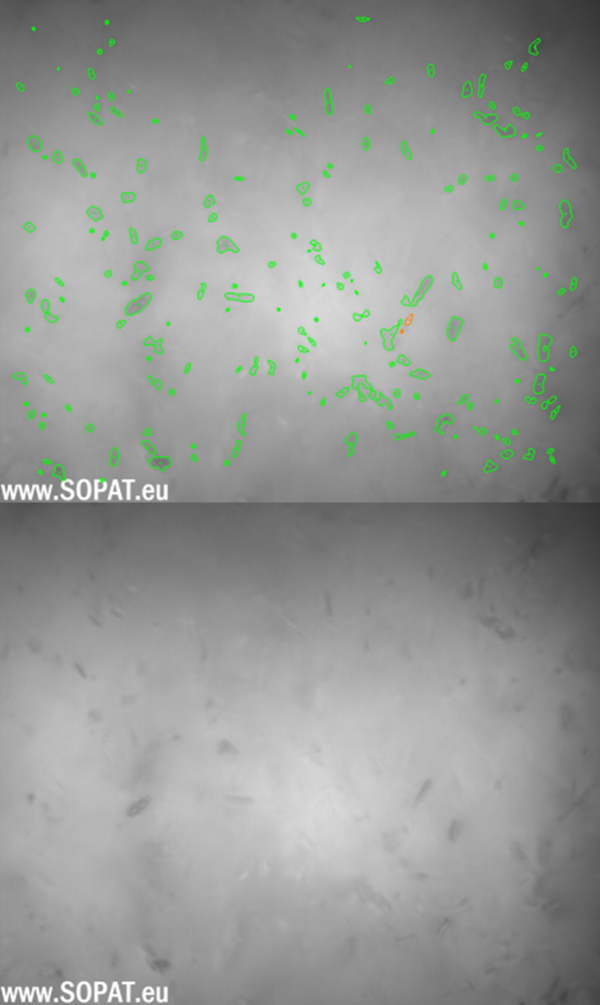

BSS nach Nassmahlung
Erschließen Sie die Leistungsfähigkeit der SOPAT-Technologie: Tauchen Sie tiefer in die Innovation ein und besuchen Sie sie auf https://www.sopat.de/de/
Haben Sie eine Anwendung für pharmazeutische APIs? Kontaktieren Sie uns science@kinematica.ch

1 Yang, Y., Ahmed, B., Mitchell, C., Quon, J. L., Siddique, H., Houson, I., Florence, A. J., & Papageorgiou, C. D. (2021). Investigation of Wet Milling and Indirect Ultrasound as Means for Controlling Nucleation in the Continuous Crystallization of an Active Pharmaceutical Ingredient. Organic Process Research & Development, 25(9), 2119–2132. https://doi.org/10.1021/acs.oprd.1c00209
2 Engstrom, J., Wang, C., Lai, C., & Sweeney, J. (2013). Introduction of a new scaling approach for particle size reduction in toothed rotor-stator wet mills. International Journal of Pharmaceutics, 456(2), 261–268.
3 SOPAT. (n.d.). INDUSTRIES & APPLICATIONS: Pharma & Biochemistry. INDUSTRIES & APPLICATIONS: Pharma & Biochemistry. Retrieved September 14, 2023, from https://www.sopat.de/en/industries-applications/pharma-biochemistry/
